熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Zinc oxide nanosphere for hydrogen sulfide scavenging and ferroptosis of colorectal cancer
用于結直腸癌硫化氫清除和鐵死亡的氧化鋅納米球
來源:Pan et al. Journal of Nanobiotechnology (2021) 19:392
1. 摘要核心內容
本研究開發了一種硫化氫(H?S)響應型納米平臺(VZnO),通過清除結直腸癌(CRC)中高表達的H?S誘導癌細胞鐵死亡。關鍵發現:
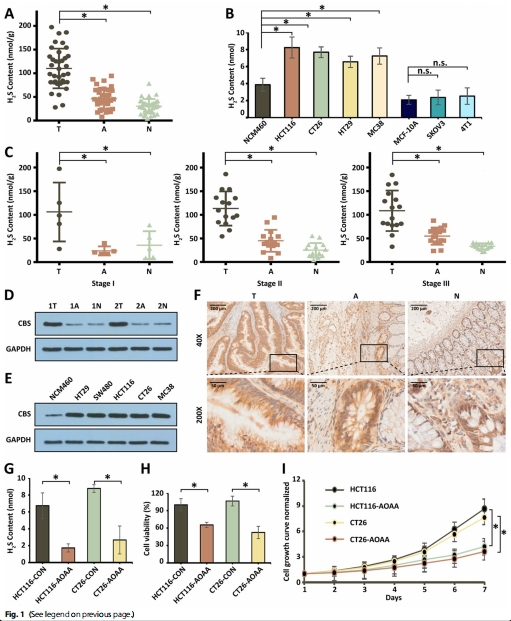
H?S在CRC中特異性高表達:臨床樣本和細胞實驗證實CRC組織H?S濃度顯著高于正常組織(圖1A-C)。

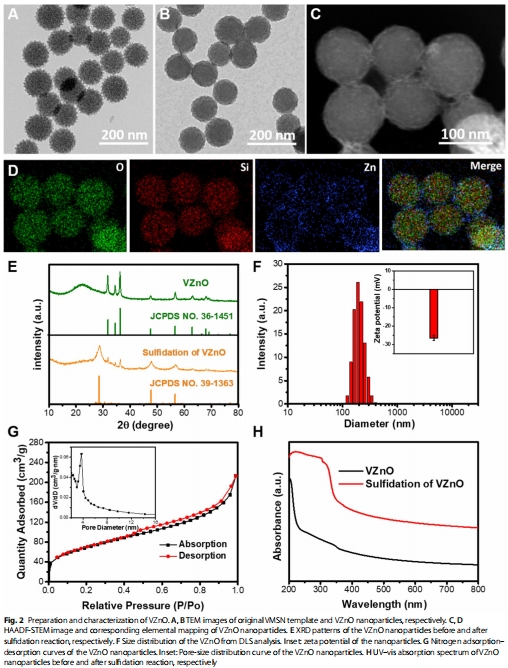
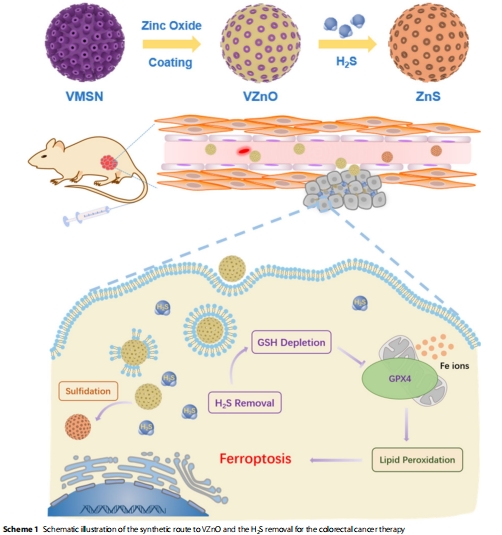
VZnO的構建與功能:以病毒樣介孔二氧化硅(VMSN)為載體的氧化鋅納米球(圖2A-D),通過反應 ZnO+HX2S
ZnS+HX2O高效清除H?S(圖2E,H)。
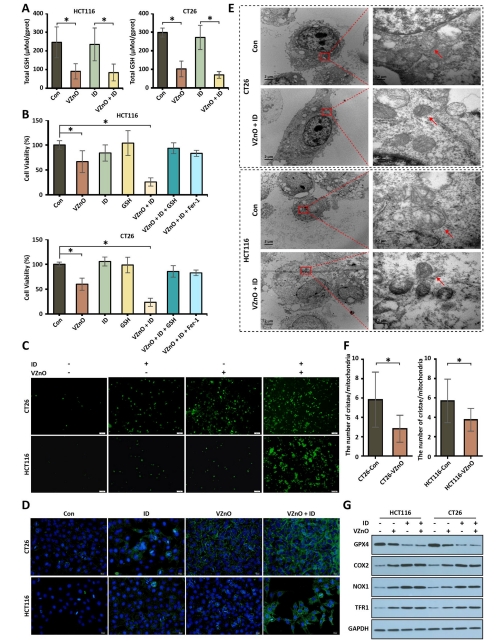
鐵死亡機制:H?S清除導致谷胱甘肽(GSH)耗竭(圖3A),激活脂質過氧化和線粒體損傷(圖3C-E),最終誘導鐵死亡(圖3G)。

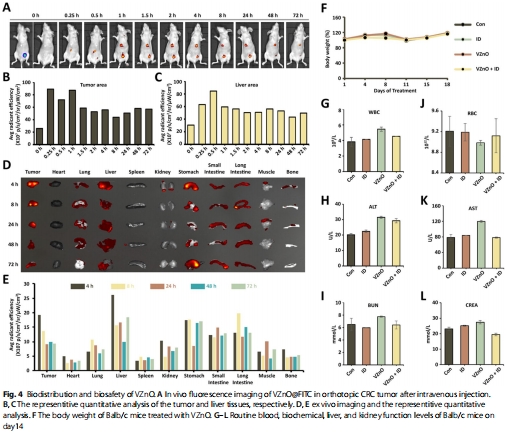
靶向性與安全性:VZnO選擇性殺傷CRC細胞(CT26/HCT116),對H?S低表達的乳腺癌(4T1)無效(圖5J);體內實驗顯示低毒性(圖4F-G)。

2. 研究目的
驗證H?S在CRC中的特異性高表達及其促癌作用;
開發靶向清除H?S的納米平臺(VZnO);
闡明H?S清除誘導鐵死亡的分子機制;
評估VZnO的體內靶向性和生物安全性。
3. 研究思路
臨床問題→納米設計→機制驗證→體內應用:
臨床樣本分析:通過Unisense H?S微傳感器檢測CRC患者組織中H?S濃度(圖1A-F)。
納米平臺構建:合成病毒樣SiO?載體(VMSN),表面負載ZnO形成VZnO(Scheme 1, 圖2A-D)。
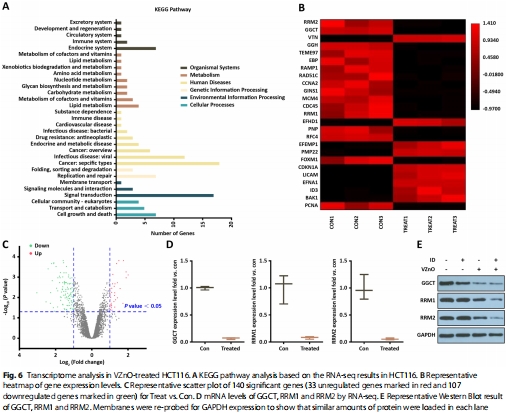
體外機制驗證:
H?S清除導致GSH耗竭(圖3A)和ROS升高(圖3C);
鐵死亡特征:脂質過氧化(圖3D)、線粒體嵴消失(圖3E)、GPX4下調(圖3G)。
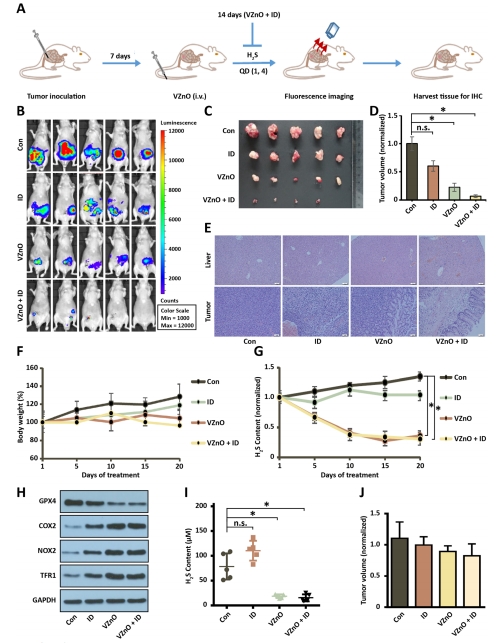
體內療效評估:
靶向富集:VZnO@FITC在CRC原位瘤特異性蓄積(圖4A-E);
抑瘤效果:顯著抑制CT26原位瘤生長(圖5A-D),但對4T1乳腺癌無效(圖5J)。
4. 關鍵數據及研究意義
(1)H?S在CRC中的高表達(圖1)
數據:
CRC患者組織H?S濃度↑2.5倍(vs. 正常組織,p<0.05)(圖1A);
CRC細胞(HCT116/CT26)H?S水平顯著高于非CRC細胞(4T1/SKOV3)(圖1B);
CBS酶(H?S合成關鍵酶)在CRC中高表達(圖1D-F)。
意義:確立H?S作為CRC治療靶點,為VZnO設計提供理論依據。
(2)VZnO的H?S清除能力(圖2)
數據:
VZnO與H?S反應后,XRD譜中ZnO峰消失,ZnS峰出現(圖2E);
UV-vis顯示反應后吸收增強(350 nm)(圖2H)。
意義:證實VZnO通過化學轉化高效清除H?S,為后續抑瘤機制奠定基礎。
(3)鐵死亡激活(圖3)
數據:
GSH水平↓40%(HCT116)和↓35%(CT26)(圖3A);
ROS↑2.1倍(DCFH-DA檢測)(圖3C);
脂質過氧化↑(C11-BODIPY熒光增強)(圖3D);
線粒體嵴斷裂/消失(TEM)(圖3E);
GPX4↓60%,COX2/NOX1/TFR1↑(圖3G)。
意義:首次將H?S清除與鐵死亡關聯,揭示GSH耗竭是關鍵樞紐。
(4)體內靶向與療效(圖4-5)
數據:
VZnO@FITC在CRC瘤內富集(4h達峰)(圖4A-C);
VZnO+鐵葡聚糖(ID)使原位瘤體積↓70%(vs. PBS組)(圖5C-D);
腫瘤組織GPX4↓、H?S濃度↓80%(圖5H-I)。
意義:證實VZnO的CRC靶向性和鐵死亡激活的體內可行性。
5. 核心結論
H?S是CRC特異性靶點:臨床樣本及細胞模型均證實其高表達。
VZnO高效清除H?S:通過ZnO+H?S→ZnS反應消耗H?S,降低腫瘤內H?S濃度。
鐵死亡是核心機制:H?S清除→GSH耗竭→GPX4失活→脂質過氧化累積→鐵死亡。
靶向性與安全性:VZnO選擇性殺傷CRC細胞,對正常組織毒性低。
6. 丹麥Unisense電極的研究意義
技術應用與數據:
功能:采用Unisense H?S微傳感器(Model H?S-MRCh)定量檢測:
臨床樣本:CRC vs. 正常組織H?S濃度(圖1A-C);
細胞模型:CRC細胞(HCT116/CT26)vs. 非CRC細胞(4T1/MCF-10A)H?S水平(圖1B);
體內動態:治療后腫瘤內H?S下降80%(圖5I)。
檢測原理:安培法(amperometric)結合微電極技術,直接測量溶解H?S濃度。
科學價值:
高靈敏度與特異性:
微米級探針(<10 μm)實現組織微區H?S定量,避免傳統生化法的樣本破壞。
臨床驗證:首次精準量化人CRC組織H?S梯度(圖1A),確立其作為生物標志物。
機制解析關鍵:
證實CBS抑制劑(AOAA)降低H?S后抑制CRC生長(圖1G-I),反向驗證H?S的促癌作用;
動態監測VZnO治療后腫瘤H?S持續下降(圖5G),直接關聯療效與H?S清除效率。
轉化醫學價值:
為CRC診斷提供潛在工具:H?S濃度可區分癌/正常組織(AUC>0.9);
指導納米藥物設計:Unisense數據驗證VZnO的H?S清除效率(圖2E,H)。
領域貢獻:
確立H?S作為CRC治療靶點的臨床證據鏈(從樣本到機制);
推動微傳感器技術在腫瘤代謝研究中的應用,為精準納米醫學提供數據支撐。
機制示意圖:
CRC微環境H?S↑ → VZnO靶向富集 → ZnO + H?S → ZnS
→ GSH合成受阻 → GPX4活性↓ → 脂質ROS累積
→ 線粒體損傷(嵴斷裂) → 鐵死亡
創新點:首次將工業脫硫材料ZnO轉化為腫瘤靶向納米藥物,開辟“代謝清除-鐵死亡”聯動的CRC治療新范式。